上海伯豪生物技术有限公司品牌商
17 年
手机商铺
- NaN
- 0.8999999999999999
- 1.9
- 0.8999999999999999
- 3.9
上海伯豪生物技术有限公司
入驻年限:17 年
- 联系人:
伯豪生物
- 所在地区:
上海
- 业务范围:
体外诊断、实验室仪器 / 设备、细胞库 / 细胞培养、技术服务、论文服务、试剂、耗材
- 经营模式:
生产厂商 科研机构 经销商 代理商
推荐产品
公司新闻/正文
文献解读 | 抗原呈递癌症相关成纤维细胞微环境的单细胞分辨率空间分析
159 人阅读发布时间:2025-12-26 16:45

期刊:Cancer Cell
影响因子:IF:44.5
主要技术:ScRNA-seq、空间转录组、Xenium
摘要
最近的研究确定了一种独特的癌症相关成纤维细胞(CAFs)亚型,称为抗原呈递CAFs(apCAFs)。为了全面了解apCAFs的起源和功能,作者构建了15种组织和实体瘤的成纤维细胞分子图谱。整合研究意外地揭示了两种不同的apCAF群体存在于大多数癌症类型中:一个与间皮样细胞相关,另一个与纤维细胞相关。使用高分辨率单细胞空间成像平台,作者表征了这些apCAF群体的空间小生境。作者发现间皮样apCAF位于癌细胞附近,而纤维细胞样apCAF与淋巴细胞富集的微环境相关。此外,发现两个apCAF群体都可以上调分泌型磷蛋白1(SPP1),这有助于原发性肿瘤的形成、腹膜转移和治疗抵抗。综上所述,这项研究为分析apCAF及其空间微环境提供了的解决方案。
主要技术
ScRNA-seq、空间转录组、Xenium
研究结果
1. 癌症相关的成纤维细胞表型在癌症类型中是保守的
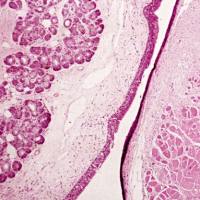
研究整合了 532 个人类样本的 scRNA-seq 数据,涉及膀胱、乳腺、结直肠等 13 个器官的肿瘤及对应正常组织。经过严格质控和批次效应校正后,鉴定出上皮细胞、T/NK 细胞、成纤维细胞等主要细胞类型,并从中筛选出表达 COL1A1、COL1A2、COL3A1 标志物的成纤维细胞,进一步聚类得到 13 个亚群。
基于分子特征和信号通路,成纤维细胞可分为 6 种主要亚型:炎症型 CAFs(iCAFs)、肌成纤维细胞样 CAFs(myCAFs)、抗原呈递 CAFs(apCAFs)、稳态样 CAFs(sslCAFs)、神经元样 CAFs 和增殖型 CAFs。
跨癌种对比显示,CAF 亚型在不同肿瘤中具有保守性,但比例存在差异。腹膜转移癌(PM)、卵巢癌(OV)和胰腺癌(PDAC)中成纤维细胞样细胞比例较高。与正常组织相比,肿瘤组织中 LRRC15+ myCAFs、两种 apCAF 亚型及增殖型 CAFs 富集,而稳态样和炎症型成纤维细胞减少,且肿瘤相关成纤维细胞整体呈现肌成纤维细胞特征和抗原呈递特征增强、炎症特征减弱的趋势。
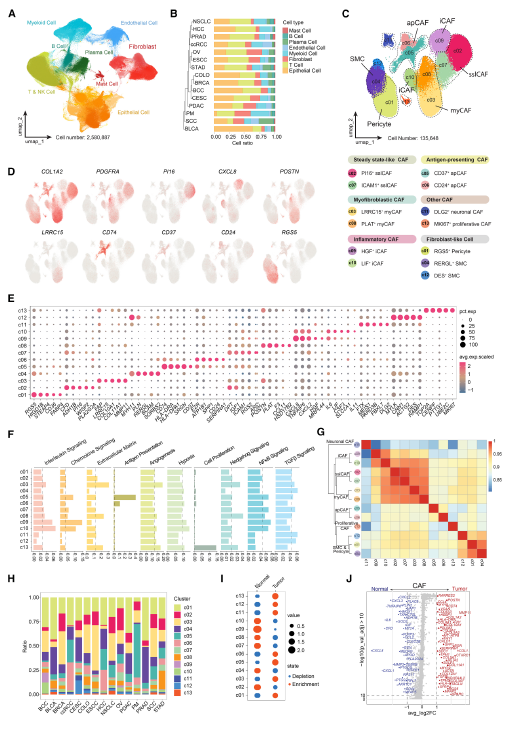
Fig 1. CAF亚型的跨组织比较
2.两种不同抗原提呈癌相关成纤维细胞群的鉴定
对 apCAF 亚群的进一步重聚类分析,发现两种起源和分子特征截然不同的 apCAF 群体:间皮样 apCAFs(M-apCAFs):表达间皮细胞标志物(MSLN、UPK3B、KRT19)和 CD24,与之前报道的间皮祖细胞起源一致,其转录调控依赖 BARX2、BHLHE41、POU5F1 等转录因子。纤维细胞样 apCAFs(F-apCAFs):携带造血细胞标志物(PTPRC/CD45、CD37、CD52),同时表达成纤维细胞特征,起源于骨髓来源的纤维细胞,转录调控由 SPI1、RUNX3、GATA3 等驱动。
伪时间轨迹分析显示,M-apCAFs 中 MSLN 下调、F-apCAFs 中 PTPRC 下调的过程均伴随 HLA II 类基因(CD74、HLA-DRA)的上调。两种 apCAF 群体均缺乏主要共刺激分子(CD40、CD80、CD86),与小鼠模型中 apCAF 诱导调节性 T 细胞的特征一致。
差异表达分析鉴定出 F-apCAF 特异性标志物(C1QC、APOC1、RARRES1)和 M-apCAF 特异性标志物(CD24、CA9、EGLN3),这些标志物组合与癌症患者不良预后显著相关。值得注意的是,两种 apCAF 均高表达SPP1,且 SPP1 表达沿伪时间轨迹升高,是强阴性预后标志物。
在癌种分布上,F-apCAF 在腹膜转移癌、肾透明细胞癌(ccRCC)、皮肤鳞状细胞癌(SCC)等中富集,M-apCAF 则在肾透明细胞癌、肝癌(HCC)、结直肠癌(COLO)等中比例较高,两者在腹膜转移癌中均有高表达,故后续以腹膜转移癌为模型展开深入研究。
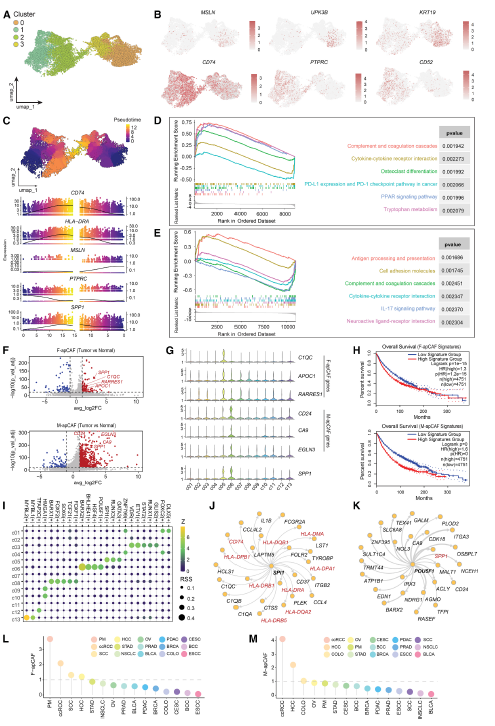
Fig 2. 两个不同的apCAF群体
3.腹膜转移的间质异质性
腹膜转移癌(PM)的基质微环境复杂,研究通过空间转录组学对 8 例结直肠癌来源的 PM 样本进行分析,将肿瘤上皮分为 iCMS2 样(类似肠上皮细胞)和 iCMS3 样(类似杯状细胞)两种亚型。其中 iCMS3 样亚型高表达 SPINK4,且 SPINK4 + 的侵袭前沿与腹膜转移风险显著相关(相对风险 = 16.5)。
基质区域分析显示,iCMS3 相关基质富集 HLA II 类抗原呈递通路和炎症相关通路。
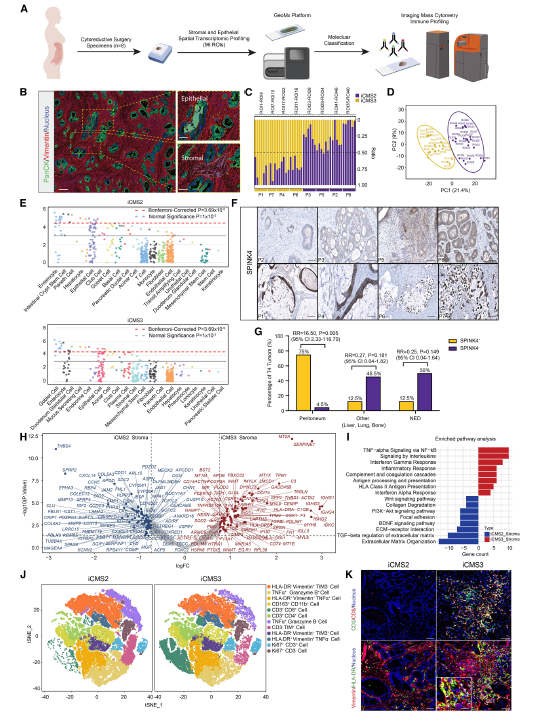
Fig 3. PM基质的分子分类
4.F-apCAFs微环境的空间分析
利用 Xenium对 8 例 PM 样本的分析,揭示了两种 apCAF 的独特空间分布模式:F-apCAF主要定位于淋巴细胞富集生态位,是该区域最丰富的 CAF 亚型。在 iCMS3 型 PM 中,F-apCAF 与淋巴细胞聚集体的平均距离显著小于 myCAFs,提示其与免疫细胞的紧密相互作用。配体 - 受体分析显示,F-apCAF 通过 CCL5 等趋化因子招募 T 细胞和单核细胞,同时表达 SPP1、LAIR1 等免疫抑制分子,在炎症性肿瘤微环境中发挥双重调控作用。
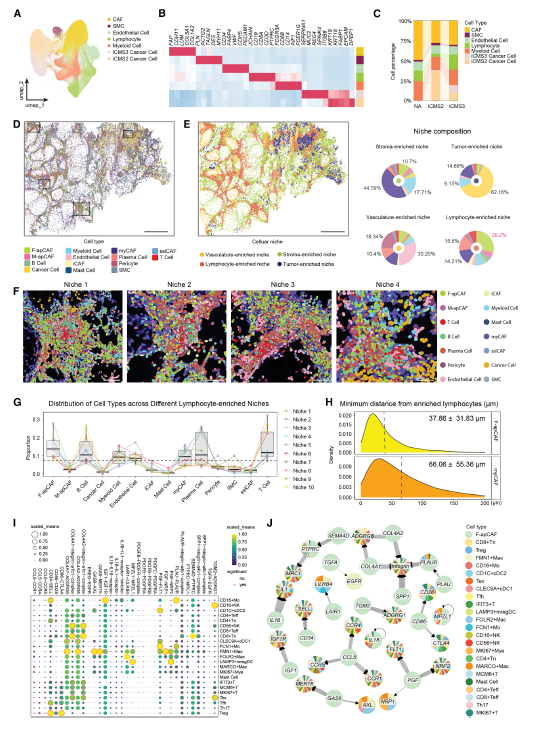
Fig 4. F-apCAF生态位的空间分析
5.M-apCAF微环境的空间分析
M-apCAF依赖组织微环境,主要位于间皮细胞富集生态位,且与肿瘤上皮相邻。该生态位中 M-apCAF 占比 23.89%,伴随髓系细胞和 T 细胞浸润,其中 T 细胞高表达免疫检查点分子(TIGIT、CTLA4、LAG3),呈现免疫抑制表型。配体-受体分析表明,SPP1 是 M-apCAF 与免疫细胞及癌细胞相互作用的关键分子。
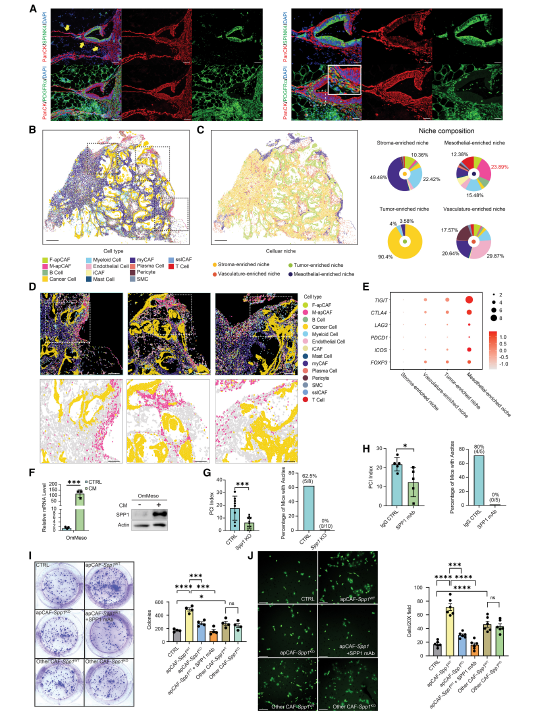
Fig 5. M-apCAF生态位的空间分析
6.敲除宿主分泌的SPP1导致腹膜和腹水形成减少
实验证实 apCAFs 是肿瘤基质中 SPP1 的主要来源,其表达水平显著高于其他 CAF 亚型、癌细胞和髓系细胞。肿瘤条件培养基可诱导间皮细胞(OmMeso、PanMeso)上调 SPP1 表达,而 SPP1 通过以下机制促进肿瘤进展:增强癌细胞迁移和侵袭能力,抗 SPP1 单克隆抗体可逆转这一效应;宿主 SPP1 敲除或抗 SPP1 治疗显著减少小鼠腹膜转移癌形成和腹水产生;apCAF 来源的 SPP1 促进癌细胞集落形成和侵袭,该作用可被抗 SPP1 抗体阻断。
7.apCAF在胰腺癌(PDAC)中的空间功能与调控作用
在PDAC模型中,放化疗后组织纤维化增强,CAF 比例升高。F-apCAF 仍富集于淋巴细胞富集区域,而 M-apCAF 则定位于 SPP1+肿瘤区域,与促肿瘤极化的SPP1+髓系细胞共存。宿主 SPP1 敲除或抗 SPP1 治疗显著抑制胰腺癌生长,apCAF 来源的 SPP1 直接增强癌细胞对 FOLFIRINOX 化疗的耐药性。
进一步机制研究显示,SPP1 促进胰腺星状细胞向 myCAF 分化,下调祖细胞标志物(Pi16)并上调成熟 myCAF 标志物(Postn、Acta2、Lrrc15),从而参与纤维化屏障形成。SPP1 敲除后,肿瘤中 T 细胞浸润增加,CAF 亚型向稳态样表型转变,且 T 细胞趋化信号增强。
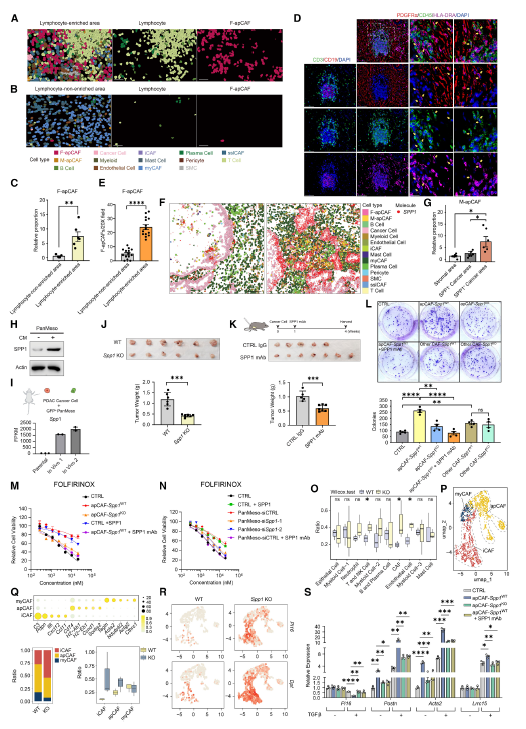
Fig 6. apCAF有助于SPP 1+肿瘤促进生态位
结论
参考文献:
Chen X, Zhou Z, Yazgan Z, Xie L, Rossi F, Liu Y, Zhang B, Polanco PM, Zeh HJ, Kim AC, Huang H. Single-cell resolution spatial analysis of antigen-presenting cancer-associated fibroblast niches. bioRxiv [Preprint]. 2024 Nov 17:2024.11.15.623232. doi: 10.1101/2024.11.15.623232. Update in: Cancer Cell. 2025 Dec 8;43(12):2224-2240.e9. doi: 10.1016/j.ccell.2025.09.001. PMID: 39605724; PMCID: PMC11601292.