上海伯豪生物技术有限公司品牌商
17 年
手机商铺
- NaN
- 0.8999999999999999
- 1.9
- 0.8999999999999999
- 3.9
上海伯豪生物技术有限公司
入驻年限:17 年
- 联系人:
伯豪生物
- 所在地区:
上海
- 业务范围:
体外诊断、实验室仪器 / 设备、细胞库 / 细胞培养、技术服务、论文服务、试剂、耗材
- 经营模式:
生产厂商 科研机构 经销商 代理商
推荐产品
公司新闻/正文
试剂盒项目文章 | NEO1通过cPLA2-MAVS信号通路调控蛛网膜下腔出血中A1型星形胶质细胞极化
104 人阅读发布时间:2026-01-19 09:43

期刊:Journal of Neuroinflammation
影响因子:10.1
通讯单位:南方医科大学
通讯作者:段传志,李西峰,刘文超
伯豪技术产品:伯优®细胞核分离试剂盒
科学问题
蛛网膜下腔出血(SAH)后的神经炎症在多种病理通路和不良预后中起着关键作用。已有研究表明,静息状态的星形胶质细胞在SAH后可极化形成至少两种不同表型:促炎的A1表型和抗炎的A2表型。单细胞测序结果显示,SAH后A1星形胶质细胞数量增加,NEO1可能参与星形胶质细胞极化过程。作者通过将NEO1fl/fl小鼠与GFAP-Cre小鼠杂交,构建了星形胶质细胞特异性NEO1条件性敲除(cKO)小鼠。利用血管内穿刺诱导的SAH小鼠模型,作者发现NEO1下调可显著抑制A1星形胶质细胞极化,并减少相关炎症因子的释放。星形胶质细胞中NEO1敲除后,cPLA2、MAVS和NF-KB的mRNA水平显著降低。已知cPLA2-MAVS相互作用在激活NF-KB转录程序中发挥重要作用,基于此作者推测NEO1通过该信号通路发挥作用,并通过体外实验,验证了这一假设。米格鲁司他(miglustat)给药可显著减轻SAH后的神经炎症,并改善神经功能恢复。综上,本文研究结果表明,抑制NEO1可通过cPLA2-MAVS通路减轻SAH后A1星形胶质细胞极化。
主要产品
伯优®细胞核分离试剂盒
(技术产品伯豪生物提供)
研究结果
1. SAH后星形胶质细胞极化呈现时间特异性,NEO1表达下调
为阐明蛛网膜下腔出血(SAH)后星形胶质细胞极化状态的改变,研究人员在动物模型建立24小时后收集实验组和对照组小鼠的脑组织进行单细胞测序。结果显示,SAH后小鼠脑组织中星形胶质细胞可分为A1和A2两个反应性亚群,其中A1星形胶质细胞数量在SAH后1天显著增加,且差异基因富集于转录因子结合和细胞因子活性相关功能,提示其在早期神经炎症中的核心作用。Western blot验证显示,SAH后C3蛋白表达逐渐升高,2天达峰值,而S100A10在1天短暂抑制后逐渐升高;NEO1表达从SAH后1天开始下调,2-3天显著降低,且神经功能缺损在1天最为严重,这些时间特征表明,SAH后第1天是后续机制研究和治疗研究的关键窗口期。
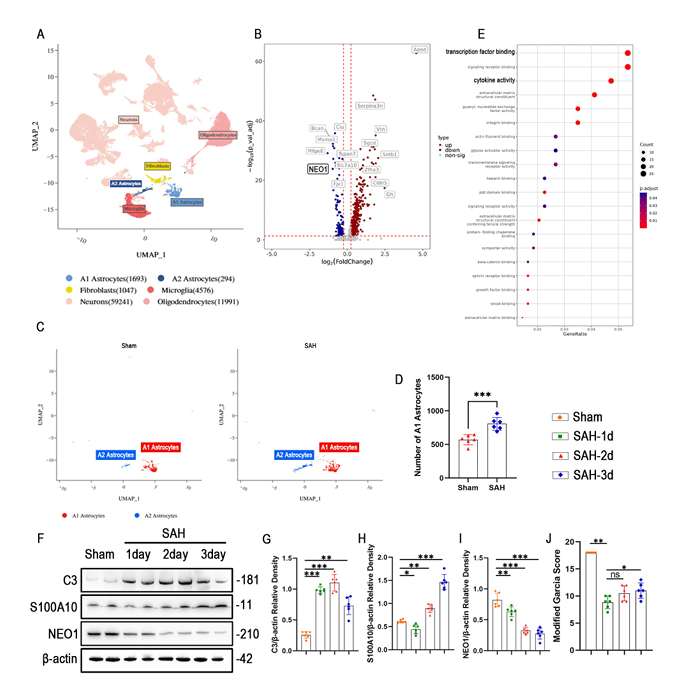
图1A SAH脑组织样本单细胞RNA分析
2. 星形胶质细胞特异性敲除NEO1抑制A1极化,改善神经炎症微环境
基于已有研究,作者推测NEO1在SAH后调控星形胶质细胞极化。为验证这一假设,作者构建了皮质星形胶质细胞特异性NEO1条件性敲除(cKO)小鼠。实验分为四组:对照组、NEO1 cKO组、SAH组和NEO1 cKO+SAH组。结果显示,与SAH组相比,NEO1 cKO+SAH组小鼠脑组织中A1表型标志物C3的蛋白表达显著降低,免疫荧光显示C3+GFAP+细胞比例减少,而A2表型标志物S100A10表达升高,S100A10+GFAP+细胞比例增加,流式细胞术进一步验证了这一转变。炎症因子检测显示,NEO1敲除显著后IL-1α、IL-1β、IL-18、TNF-α等促炎因子水平降低,抗炎因子IL-10表达升高,同时Fluoro-Jade阳性退变神经元数量减少,神经元超微结构有明显改善,表明NEO1敲除可通过调节星形胶质细胞极化减轻神经炎症和神经元损伤。
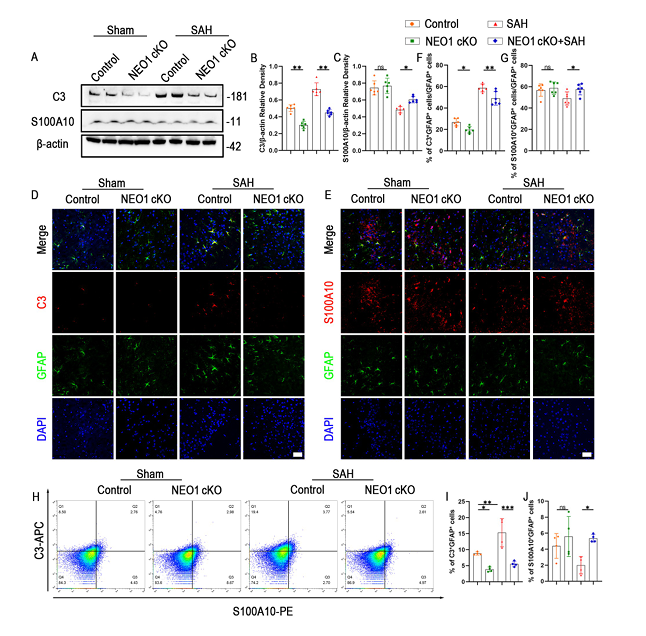
图2 星胶特异性敲除NEO1对SAH后A1/A2星形胶质细胞活化的影响
3. NEO1通过cPLA2-MAVS-NF-KB通路调控星形胶质细胞极化
为探究NEO1介导的星胶极化的分子机制,研究人员对星胶特异性NEO1 cKO小鼠的大脑皮质组织进行转录组测序。结果显示,NEO1 cKO小鼠脑组织中cPLA2(PLA2G4A)、MAVS、NF-KB(NFKB1)的mRNA水平显著下调,Western blot验证显示,NEO1敲除后cPLA2、MAVS、NF-KB及磷酸化NF-KB的蛋白表达均显著降低。免疫荧光共定位显示,NEO1 cKO小鼠脑组织中cPLA2+MAVS+GFAP+三重阳性细胞比例减少,体外实验进一步证实,HB刺激可诱导原代星形胶质细胞中cPLA2、MAVS表达升高,而NEO1敲除可逆转这一效应。慢病毒介导cPLA2过表达后,NEO1敲除引起的C3表达降低、S100A10表达升高现象被显著逆转,同时促炎因子水平回升,神经元毒性增强,直接证明cPLA2-MAVS通路是NEO1调控星形胶质细胞极化的关键下游机制。
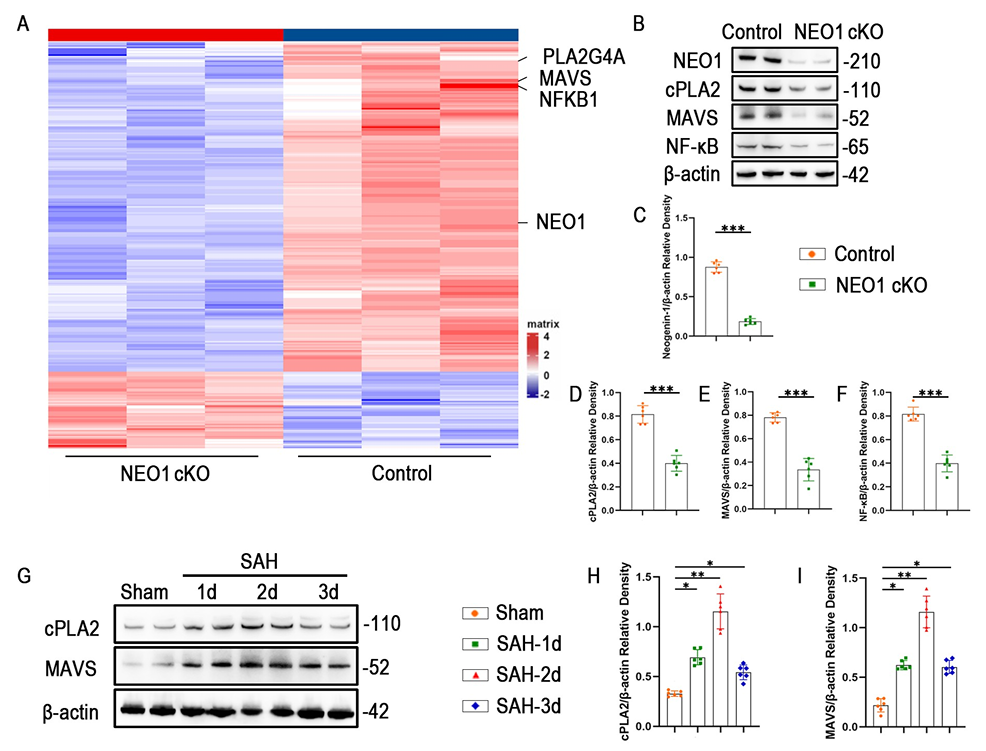
图3 星形胶质细胞中敲除NEO1可下调cPLA2和MAVS的表达
4.米格鲁司他靶向通路改善SAH预后
作者采用600mg/kg剂量,研究米格鲁司他(miglustat)对SAH后神经炎症的影响。Western blot表明,米格鲁司他给药抑制A1星形胶质细胞极化,促进A2星形胶质细胞极化。SAH+miglustat组小鼠的改良Garcia评分显著高于SAH组,脑含水量显著降低,旷场实验中运动功能和探索行为明显改善。机制上,米格鲁司他处理后C3表达显著降低,S100A10表达升高,同时促炎因子(IL-1α、IL-1β等)下调,IL-10上调, Fluoro-Jade阳性退变神经元数量减少,表明米格鲁司他通过抑制cPLA2-MAVS通路,调节星形胶质细胞极化,从而减轻神经炎症和脑损伤。
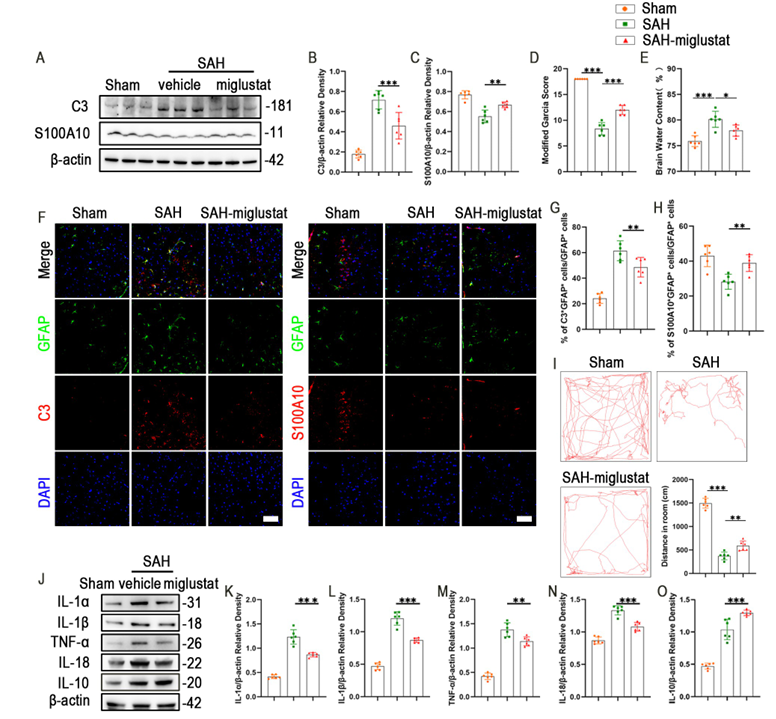
图4米格鲁司他给药促进SAH后小鼠神经功能恢复
研究意义与展望
该研究通过严谨的实验设计,首次阐明了NEO1在SAH后A1星形胶质细胞极化中的关键调控作用,建立了“NEO1-cPLA2-MAVS-NF-KB”调控网络,为理解SAH后神经炎症的分子机制提供了全新视角。星形胶质细胞特异性敲除NEO1和米格鲁司他干预的显著疗效,证实了该通路作为治疗靶点的可行性,尤其米格鲁司他作为已获批临床应用的药物,其在SAH中的转化潜力为临床治疗提供了新的快速转化方向。
参考文献:
1. Wu Y., Wei B., Jin L. et al. NEO1 modulates the A1 astrocyte polarization in subarachnoid hemorrhage through the cPLA2-MAVS signaling pathway. J Neuroinflammation (2025). s12974-025-03643-9
本产品专为从动物组织中分离高纯度的单细胞核而设计。组织通过匀浆、裂解细胞膜等步骤释放完整细胞核,同时维持核膜稳定性及染色质空间结构,优化的密度梯度离心或离心管柱技术可进一步去除细胞碎片和杂质,从而可满足下游单细胞组学、表观遗传学等前沿研究领域对细胞核的质量要求。本产品突破传统解离法对样本活性的依赖,广泛适用于新鲜或新鲜冰冻组织,并兼容微量组织(<10 mg);全流程操作简捷,为复杂样本提供标准化的解决方案。