上海伯豪生物技术有限公司品牌商
17 年
手机商铺
- NaN
- 0.8999999999999999
- 1.9
- 0.8999999999999999
- 3.9
上海伯豪生物技术有限公司
入驻年限:17 年
- 联系人:
伯豪生物
- 所在地区:
上海
- 业务范围:
体外诊断、实验室仪器 / 设备、细胞库 / 细胞培养、技术服务、论文服务、试剂、耗材
- 经营模式:
生产厂商 科研机构 经销商 代理商
推荐产品
公司新闻/正文
项目文章 | 肝脏驻留的CD3 +巨噬细胞在小鼠乙型肝炎模型中HBV清除的潜在作用
573 人阅读发布时间:2025-01-20 14:00

期刊:JHEP Reports
影响因子:9.5
伯豪技术服务产品:伯豪单细胞测序服务、伯优®单细胞测序组织保存液
导语
肝脏是一种特殊的器官,具有独特的免疫特性和对食源性抗原的耐受性。新生儿接触HBV后会发生慢性感染;而急性感染通常发生在成年人身上,这表明肝组织微环境中的免疫细胞也可以有效地对抗病毒。关于急性HBV感染机制的研究很少。在这项研究中,我们在急性HBV模型小鼠的肝脏中发现了兼具有T细胞和巨噬细胞特征的巨噬细胞群,并揭示了这些巨噬细胞在HBV清除中发挥重要作用。此外,我们证实这个群体是在病毒特异性T细胞和抗体存在的情况下从巨噬细胞衍生而来。这一发现凸显了肝脏微环境中抗病毒免疫反应的复杂性。
主要技术
scRNA‐seq,免疫组化, 细胞培养,流式分选、伯优®单细胞测序组织保存液(技术服务产品由伯豪生物提供)
研究结果
1. HBV小鼠肝脏微环境中免疫细胞的单细胞分析
所有HBV小鼠肝脏中的免疫细胞被鉴定为24个簇(图1B ,左),包括B、巨噬细胞、CD8 + T、CD4 + T、NK、粒细胞、树突状细胞( DC )、NKT、Treg、MAIT和浆细胞(图1B ,右),并通过星戈勒软件进行注释。热图用于显示用于细胞定义的基因(图1C )。它们在不同小鼠体内的分布情况见图1D。标志性基因包括Cd79a ( B和Plasma)、Csf1r ( Macrophage )、Cd8a ( CD8 + T )、Cd4 ( CD4 + T )、Ncr1 ( NK )、S100a8 ( Granulocyte )。
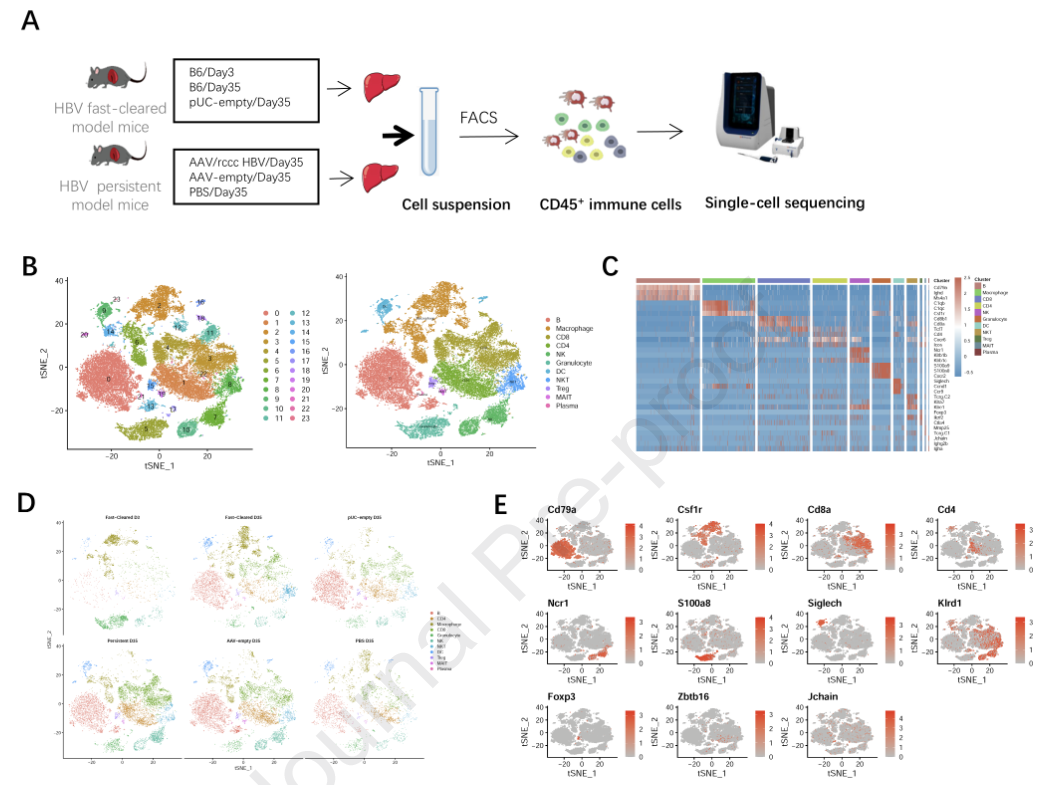
2. HBV小鼠模型中髓系来源的细胞组成
单核细胞源性巨噬细胞( MoMs )分为3个亚群(簇2、5和13),组织驻留kuffer细胞分为4个亚群(聚类0、6、10、12)。粒细胞也分为3个亚群(簇1 , 7和11),而DC分为4个亚群:c DC-1 ( cluster 3 )、c DC-2 ( cluster 8 )、p DC-1 ( cluster 4 )和p DC-2 ( cluster 9 ) (图S2A )。在HBV快速清除小鼠中,单核细胞、粒细胞- 1和cDC - 1的百分比在第3天急剧增加(图2E )。此外,在第35天,pDC - 1在HBV快速清除模型中比第3天大,这表明它不是病毒清除的关键群体。其中,巨噬细胞具有高度异质性。所有的MoMs簇都具有较高的Cx3cr1,表明它们是由外围迁移而来的种群。MoM - 1中Fn1升高,提示其为单核细胞早期分化的亚群。C1qa在Kupffer cluster 1 ~ 4中的高表达表明它们是组织定居细胞。Kupffer-cluster 1细胞被发现是表达高水平APOC1和MRC1的M2样巨噬细胞,在CHB肝脏中积累并有助于组织修复。S100a8和S100a9富集的Kupffer - cluster 3被认为是免疫抑制细胞。有趣的是,Cd3e和Cd3g在Kupffer - cluster 2 ( Red arrow )中高表达。含有Spic基因的Kupffer - cluster 4亚群几乎只存在于HBV快速清除模型(图2F和G)中,提示其为红髓巨噬细胞。在35天的HBV快速清除和持续感染小鼠的肝脏中,该簇的比例显著增加(图2F ),但其数量仅在35天的HBV快速清除小鼠中增加(图2G )。由于这种快速清除模型中的HBV清除通常发生在建模后的第3周至第4周,因此该簇可能是参与清除HBV的新型巨噬细胞群。
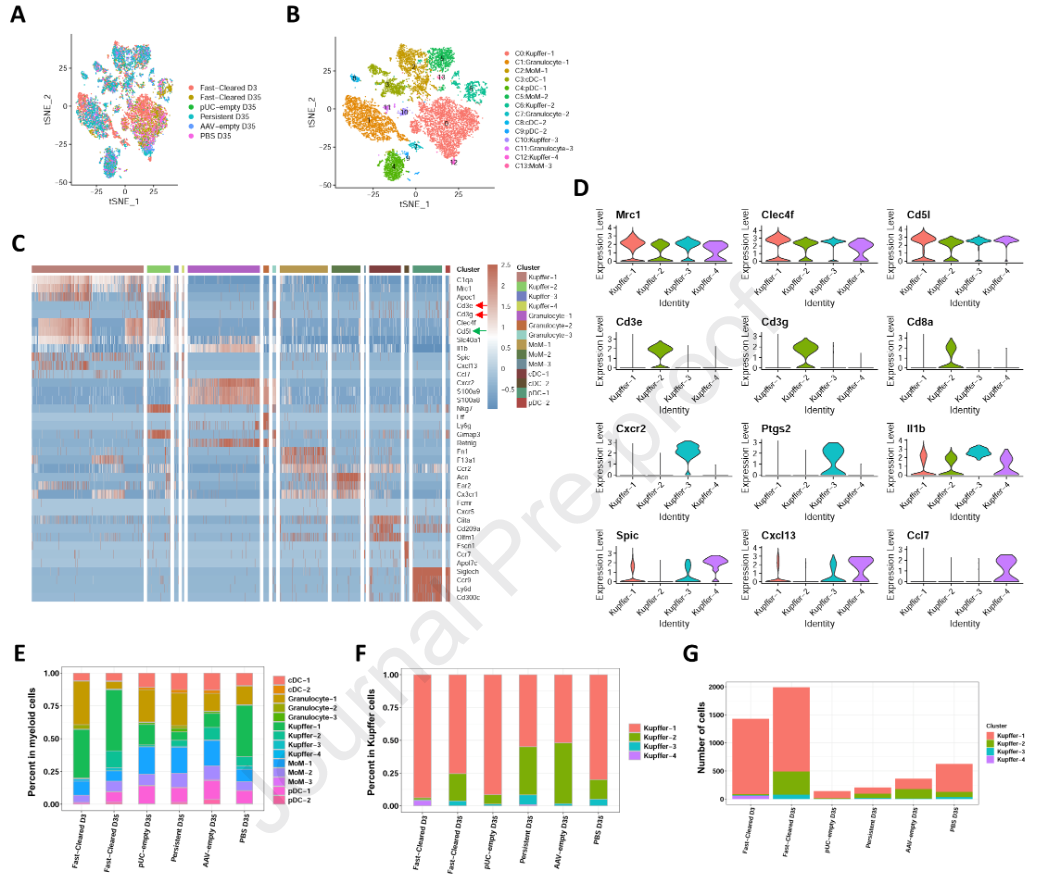
3. HBV清除过程中肝内CD3 + Kupffer细胞的鉴定
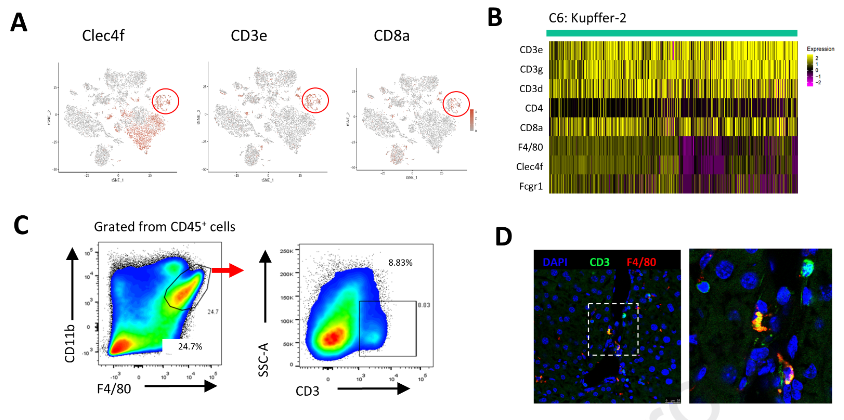
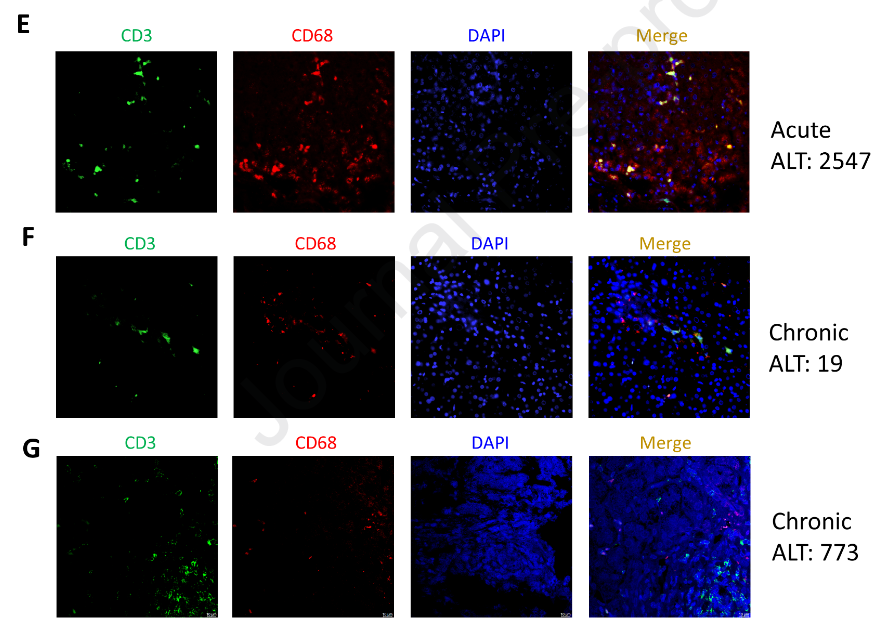
值得注意的是,除了Clec4f,Kupffer-cluster 2还高表达T细胞基因CD3e和CD8a (图3A )。这些细胞也显示CD3g,CD3d,Adgre1 ( F4 / 80 )和Fcgr1 ( CD68 )表达增加,但不表达CD4 (图3B )。尽管如此,仍有可能由于细胞粘附而检测到这些CD3 +巨噬细胞。为了排除这种现象,我们进一步分析了细胞的线粒体基因,其表达量在2.5 % ~ 5.0 %之间,表明它们不是黏性细胞。然后我们通过共聚焦显微镜观察分选的CD3 + Kupffer细胞,发现其与巨噬细胞相似,呈现不规则的形态,并与CD3和CD8共表达F4 / 80 (图S3A )。为了进一步验证sc RNA - seq在肝脏中发现的CD3 + Kupffer亚群,对快速清除小鼠的血清HBsAg进行动态监测,并于第5周处死小鼠。分离肝内非实质细胞并用流式细胞术检测。CD3 +细胞由F4 / 80highCD11b + Kupffer细胞分化而来。如图3C所示,CD3 +巨噬细胞约占Kupffer细胞总数的8.83 %。此外,通过肝脏免疫荧光染色观察到CD3 + F4 / 80 +巨噬细胞(图3D ),证实了sc RNA - seq的发现。接下来质疑这些CD3 +巨噬细胞是否存在于乙肝患者中。收集5例急性乙肝患者和10例慢性乙肝患者的肝组织活检标本。进一步对肝活检样本进行HE染色和多重荧光标记。HE染色显示急性期患者比慢性期患者肝脏浸润更多的免疫细胞。CD3 +巨噬细胞在急性乙肝患者( n = 5 ,图3E ,图S3C - F)的肝组织中检测到,而在CHB患者( n = 10 )的肝组织中未检测到,无论ALT (图3F和G )是否升高。这些发现提示CD3 +巨噬细胞数量增加。
4. 通过抗原、抗体和抗原特异性T细胞的综合作用产生CD3 +巨噬细胞
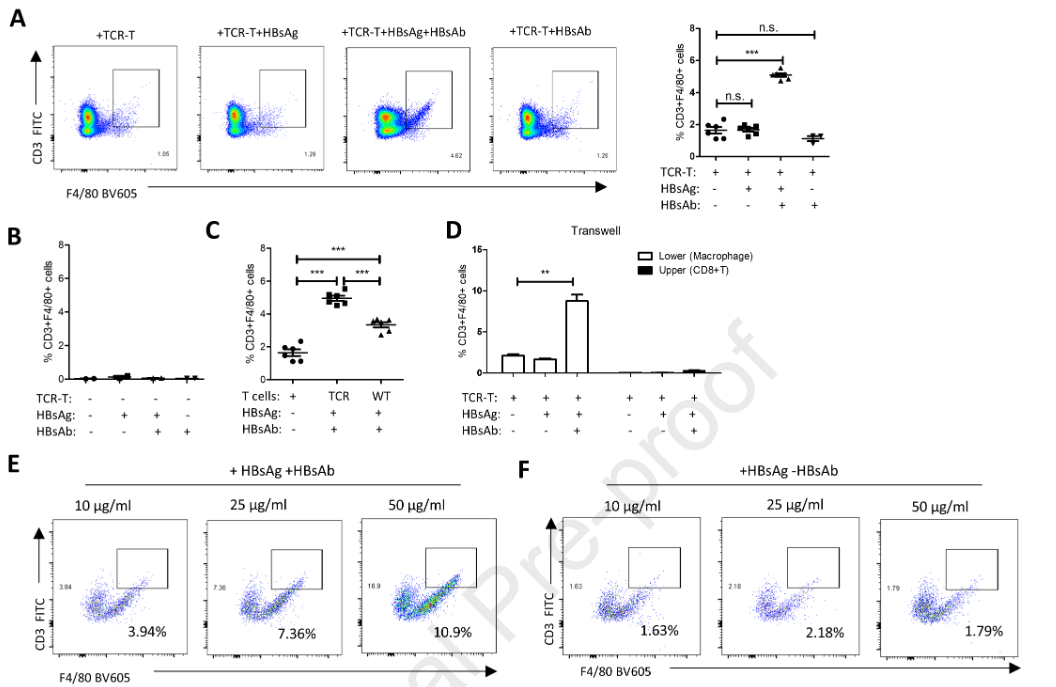
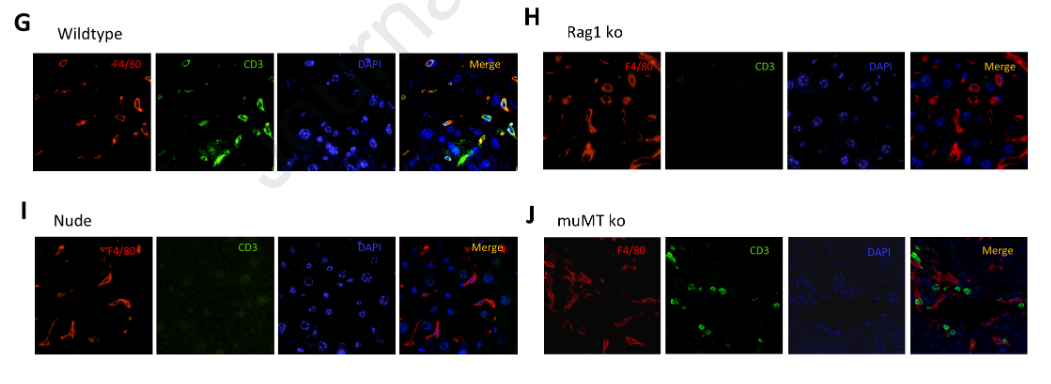
为了明确CD3 +巨噬细胞是否是由HBsAg特异性CD8 + T细胞和肝内巨噬细胞相互作用产生的,我们将HBsAg TCR转基因小鼠(杰克逊实验室, No.027510)的CD8 + T细胞和野生型小鼠的肝内巨噬细胞共培养。在共培养体系中加入HBsAg模拟HBV感染,结果显示单独HBsAg不能诱导CD3巨噬细胞(图4A )。考虑到这些细胞存在于快速清除或急性HBV感染的患者中,加入了抗HBsAg抗体( HBsAb )。结果显示,在HBsAg TCRtg CD8 + T细胞存在的情况下,HBsAg和HBsAb联合可高效诱导CD3 +巨噬细胞(图4A )。在没有T细胞存在的情况下,加入HBsAg和/或IFN - γ后,巨噬细胞没有向CD3 +表型转化。然后我们将TCRtg T细胞替换为野生型CD8 + T细胞。CD3 + F4 / 80 +细胞群也增加,但明显低于TCRtg T细胞组(图4C )。另一个问题是CD3 +巨噬细胞是来源于T细胞还是巨噬细胞,因为在肝脏中已经证明了CD14阳性的CD8 + T细胞的富集。因此,我们进行了transwell实验,在接种巨噬细胞的下室中发现了CD3 + F4 / 80 +细胞,而在含有T细胞的上室中没有发现CD3 + F4 / 80 +细胞(图4D )。此外,HBsAg和HBsAb剂量依赖性地诱导这些CD3 +巨噬细胞(图4E )。这一过程也依赖于HBsAg和HBsAb的结合,而单独加入HBsAg则没有影响(图4F )。为了进一步评估体内CD3 +巨噬细胞的生成,我们在Rag1敲除的(缺乏成熟的T、B细胞)、胸腺缺陷的裸鼠(缺乏成熟的T细胞)和muMt敲除的(缺乏成熟的B细胞)小鼠中构建了HBV快速清除模型。在高压水动力注射HBV B6质粒后的第4周至第5周之间处死小鼠。肝脏组织用F4 / 80和CD3抗体染色。CD3和F4 / 80双阳性细胞在野生型小鼠中可见(图4G ),而在Rag1基因敲除、胸腺缺陷裸鼠和mu Mt基因敲除小鼠(图4H、I、J)的肝脏中未见。这些数据表明CD3 +巨噬细胞来源于肝内巨噬细胞。
5. CD3 +巨噬细胞具有在肝脏长期驻留的特点
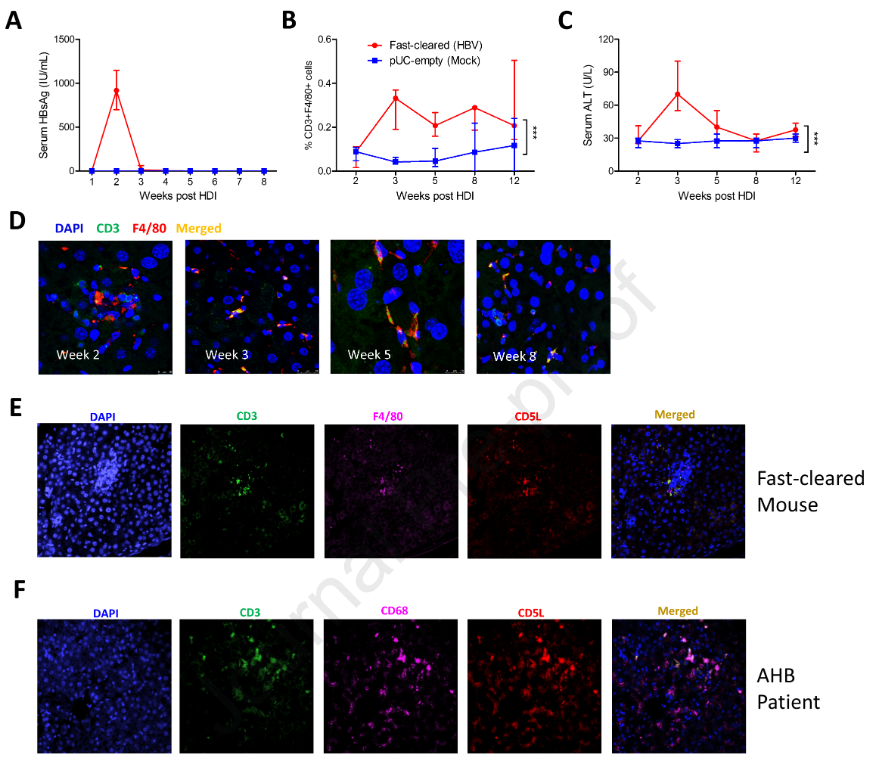
接下来,我们研究了HBV清除后CD3 +巨噬细胞是否消失。选取6周龄C57BL / 6小鼠构建HBV快速清除小鼠模型,分别于造模后2、3、5、8、12周动态监测小鼠肝脏CD3 +巨噬细胞数量。从第三周开始,随着HBsAg水平的降低(图5A ),CD3 +巨噬细胞的比例达到峰值( 0.4 % )。该亚群的比例在第五周略有下降(图5B )。然而,在HBsAg水平下降之前,这些快速清除小鼠的CD3 + Kupffer细胞数量在建模后的第二周内仍然很低(图5B )。有趣的是,CD3 +巨噬细胞一直持续到12周(图5B ),尽管ALT从第5周开始下降(图5C )。通过共聚焦显微镜也证实了小鼠肝脏中CD3 +巨噬细胞的动态变化。从第3周到第8周观察到CD3 + CDF4 / 80 +双阳性巨噬细胞(图5D )。我们随后分析了scRNA - seq数据以确定巨噬细胞凋亡的已知抑制剂CD5L的水平,并在scRNA - seq图( Kupffer-cluster 2 ,图2C ,绿色箭头)中发现CD5L的表达在CD3 +巨噬细胞中显著上调。CD5L蛋白也被发现与CD3和F4 / 80i小鼠肝组织共定位(图5E ),这在急性乙型肝炎患者的肝活检组织中得到证实(图5F )。
6. CD3 +巨噬细胞是抗HBV的多功能群体
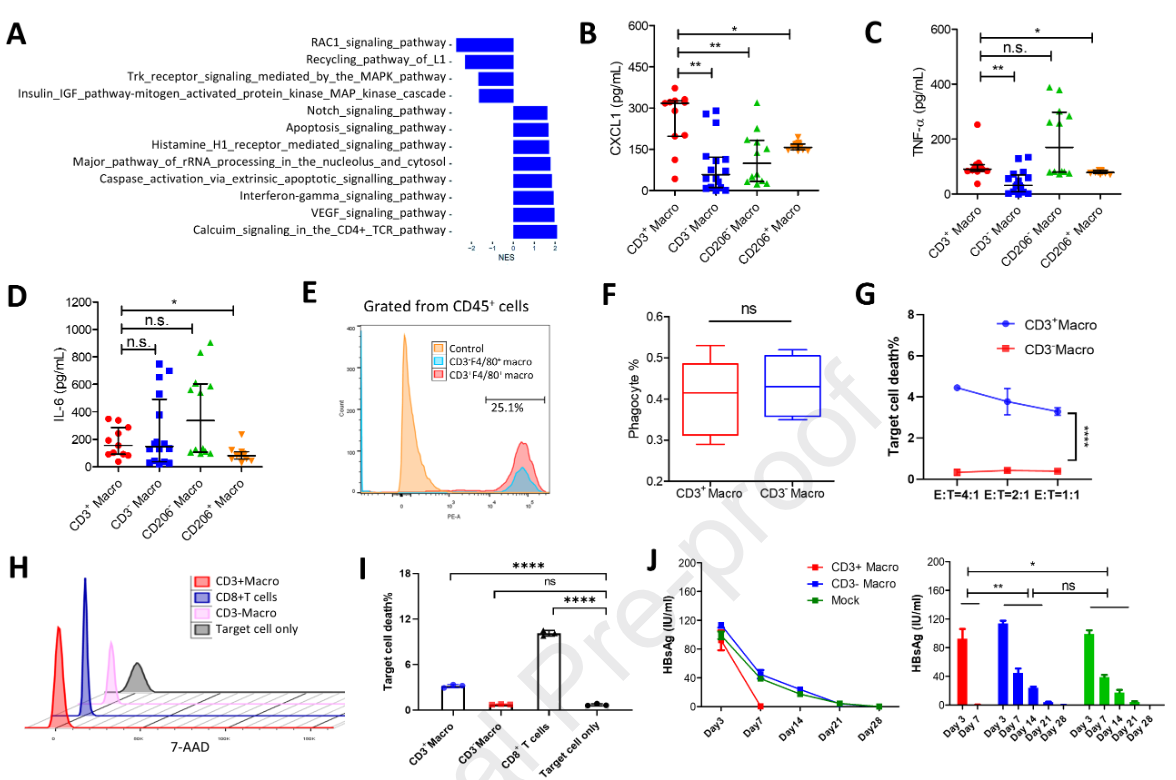
CD3 +巨噬细胞的功能非常引人注目。通过GSEA对sc RNA - seq数据进行富集分析发现,Notch、VEGF和干扰素- γ信号通路在CD3 +巨噬细胞中被激活(图6A )。选取CD3 +巨噬细胞进行培养,表达促炎活化相关细胞因子。然后,收集上清,检测10种细胞因子( IFN - γ、IL - 10、IL - 12p70、IL1 β、IL - 2、IL - 4、IL - 5、IL - 6、CXCL1、TNF - α)。此外,从小鼠肝脏中分选的CD206 +巨噬细胞作为M2型组织修复巨噬细胞,CD206 -巨噬细胞作为M1型促炎活化巨噬细胞亚群进行比较。如图6B所示,CD3 +巨噬细胞高表达CXCL1 ( 257.84 pg / ml ),与CD3巨噬细胞、CD206 +巨噬细胞和CD206 -巨噬细胞有显著差异。转录分析(图S4G - I)结果显示,CD3 +巨噬细胞培养上清中TNF - α水平显著升高( 101.86 pg / ml ) (图6C )。此外,IL - 6水平也较高,平均值为172.09 pg / ml,但低于CD206 -巨噬细胞(图6D)。接下来,我们研究CD3 +巨噬细胞在体内是否可以促进HBV的清除。这些细胞从HBV快速清除小鼠体内分离并过继转移到HBV小鼠体内。每只小鼠采用的细胞数为5 × 105个。在不同时间点采集血液标本,动态观察血浆中HBsAg的变化。在接受CD3 +巨噬细胞的小鼠中,HBsAg水平迅速下降,并在第7天被清除(图6J )。相反,与未转染的mock处理的小鼠相比,接受CD3 -巨噬细胞的小鼠并没有表现出加速的HBsAg清除(图6J )。这些发现提示CD3 +巨噬细胞在体内促进HBV的清除。
总结
我们利用scRNA - seq对HBV暴露小鼠的肝脏免疫微环境进行了研究,揭示了长期驻留的CD3 +巨噬细胞具有吞噬和细胞毒性功能。这些发现有助于阐明肝内免疫应答在清除HBV中的作用,并为CHB的治疗建立潜在的治疗策略。
参考文献:
Wang C, Zai W, Zhao K, Li Y, Shi B, Wu M, Zhou X, Kozlowski M, Zhang X, Fang Z, Yuan Z, Potential role of liver resident CD3+ macrophages in HBV clearance in a mouse hepatitis B model, JHEP Reports, doi.org/10.1016/j.jhepr.2024.101323.